Nos publications
Retrouvez les publications des groupes de travail de l’association

Innovation et Recherche Clinique en France : Des innovations disruptives pour les études sur données secondaires
L’exploitation de données secondaires a pris ces dernières années une importance majeure dans les études en vie réelle. Il y a encore quelques années, la majorité de ces études reposaient sur l’exploitation de données primaires, alors qu’aujourd’hui ce rapport s’est inversé au profit des études reposant sur des données secondaires.
Cependant, d’autres solutions innovantes offrent une alternative pour dépasser leurs limites.
Des experts institutionnels et industriels ont partagé leur point de vue sur ces nouvelles sources de données.

Etudes observationnelles avec des données standardisées : le format OMOP
Pour accroître leur potentiel d’utilisation, les bases de données peuvent être standardisées vers des modèles reconnus à l’échelle internationale et largement utilisés, comme l’OMOP-CDM (Observational Medical Outcomes Partnership-Common Data Model), les rendant ainsi interopérables avec d’autres bases de données car partageant la même structure et utilisant les mêmes terminologies.
En France, plusieurs bases de données ont été ou sont en cours de traduction au format OMOP, que ce soient des dossiers médicaux hospitaliers, des dossiers médicaux de médecine générale ou le SNDS (Système National des Données de Santé).

Cycle de vie des produits de santé : quand et comment impliquer les patients
Les données d’expériences patients sont de plus en plus recueillies et considérées à chaque étape du cycle de vie des produits de santé. En intégrant la voix des patients, les concepts importants tels que la décision médicale partagée, la qualité de vie du patient, ainsi que l’amélioration de la qualité des soins peuvent être pris en compte dans l’évaluation et la surveillance de ces produits. […]
Fortement appréciée et recommandée par les autorités de santé, l’implication des patients apporte une connaissance indispensable dans la mise en place des études, notamment au niveau de l’expérience patient.

AI Act & Recherche Clinique, comment se préparer ?
La régulation européenne (AI ACT) mais aussi internationale (US, Canada, Chine, Arabie Saoudite, et celles qui vont suivre) est un véritable choc règlementaire et va impacter les business modèles, la compétence des équipes de recherche clinique et la conception même des essais et des process.
Résumé de l’entretien croisé avec Hubert Méchin, Président des Entreprises de la Recherche Clinique (AFCROs) et Nathalie Beslay, avocate, experte de ces
sujets.

Appariement de données primaires et secondaires en France : Quand ? Comment ? Et pour quels usages ?
L’appariement de données primaires et secondaires correspond au rapprochement de données de plusieurs bases sources distinctes. Les données primaires sont des informations spécifiquement collectées pour étudier un objectif particulier. Les données secondaires sont des informations qui ont déjà été collectées dans un but différent de celui de l’étude menée et qui sont à disposition pour une seconde utilisation. L’intérêt de ce rapprochement est de maximiser la qualité et la quantité de variables disponibles pour les analyses, et répondre ainsi de façon optimale à la question posée.

Le SNDS pour les nuls… 67 millions de Français et moi et moi et moi…
Le SNDS (Système National des Données de Santé) représente une base de données unique au monde, celle de l’Assurance Maladie soit 67 millions de français.
Ce recueil de données est alimenté, d’une part, par les informations concernant l’ensemble des hospitalisations en France. Ce sont des informations administratives (établissements, durée de séjour, modalités d’entrées et de sorties de l’hôpital…) et des informations sur les patients eux-mêmes (diagnostics, actes réalisés, décès…).
Et, d’autre part, par des informations diverses sur les personnes (âge, sexe, type de pathologie) et sur la consommation de soins (consultations, médicaments, analyses de sang, transport médical…).
Ces données sont complétées par les données relatives aux certificats de décès (CépiDC) de l’INSERM.

Patients et recherche clinique, le modèle inspirant de la co-construction
Les études co-construites avec les patients permettent d’améliorer les capacités d’inclusion, la fluidité de son déroulement mais aussi la qualité des résultats, de spécifier les attendus « qui comptent » pour les patients, de partager la pertinence des objectifs et de les adapter, mais aussi d’ouvrir de nouveaux points de vue de recherche sur des critères jusque-là trop souvent ignorés (fatigue, qualité de vie sexuelle, difficulté au travail, mais aussi qualité de vie post intervention, etc.).
« Intégrer les patients dès la recherche clinique, par-delà d’être une exigence
éthique selon nous, est une formidable opportunité d’amélioration de tout projet
de recherche. Grâce à la co-construction, on bâtit une étude plus fluide, plus
engageante et in-fine, aux résultats qui comptent -vraiment- tant pour la
communauté scientifique que les patients eux-mêmes ! », nous rappelle Hervé Servy de la CRO Sanoïa qui pilote le groupe de travail de l’AFCROs : Les Patients Au Coeur de la Recherche Clinique.

Evaluations quantitatives des Expérimentations art.51 : catalyseurs de la culture d'évaluation basée sur les données de santé en France
L’évaluation quantitative des expérimentations article 51 constitue un pilier essentiel pour la transformation du système de santé en France et la promotion d’une culture d’évaluation basée sur les données de santé. Malgré les défis liés à l’accessibilité et à la qualité des données, ainsi qu’à la durée des expérimentations, ce déploiement massif d’évaluations en vie réelle ouvre de nouvelles perspectives pour l’écosystème.
Une collaboration efficace, notion clé de l’article 51, entre les acteurs du système de santé estessentielle pour surmonter les obstacles juridiques, techniques et organisationnels, tout en garantissant l’accès aux données.
L’utilisation des données médico-administratives du SNDS joue un rôle clé dans ces évaluations, permettant une évaluation plus précise de l’efficience des interventions et favorisant la création et la validation d’algorithmes réutilisables. Cette approche améliorera la qualité des recherches futures basées sur ces données.

Réutilisation des données de santé en vie réelle dans les études cliniques décentralisées
Des essais cliniques décentralisés (DCTs) basés exclusivement sur la réutilisation de données secondaires couplée à la collecte de données primaires directement auprès des patients (ePRO, et dispositifs connectés) ont déjà eu lieu aux USA. Si des études totalement décentralisées et dématérialisées sont encore impossibles en France, il existe des solutions permettant de s’en approcher en attendant que la règlementation évolue.
Dans cet article, Alexandre Malouvier et Lise Radoszycki, membres du groupe de travail RWD de l’AFCROs, vous proposent d’examiner les concepts clés qui permettent de réutiliser les données de vie réelle et les enjeux de cette réutilisation pour la recherche clinique.
Enfin, ils vous présentent trois exemples de solutions innovantes basées sur la réutilisation des données de vie réelle, que leurs dirigeants sont venus nous présenter lors d’un petit déjeuner organisé le 30 mars dernier.
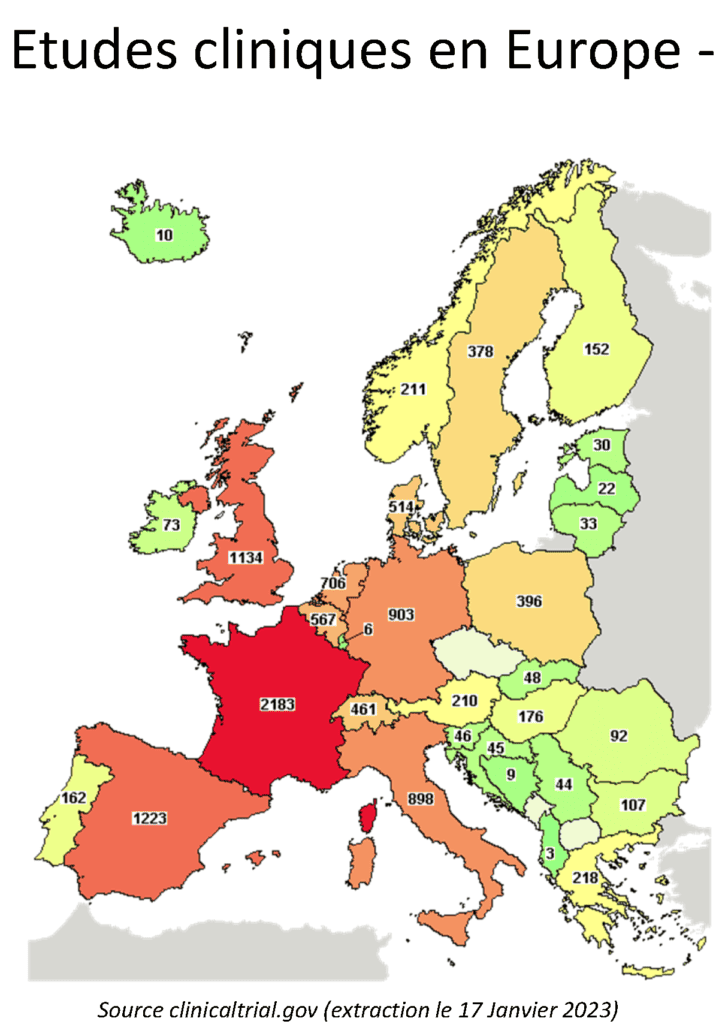
Chiffres clés de la recherche clinique en France La place de la France en Europe
- La France reste un des leaders européens en recherche clinique sur l’année 2022 et renforce même sa position sur certains secteurs.
- On note une légère baisse de l’activité de recherche en 2022 dont les recherchers sur les Maladies Rares, avec la France positionnée en leader sur les recherches sur le Cancer par exemple.
- Le Covid devient négligeable en termes de nombre d’études menées au cours de l’année 2022.
- La recherche clinique Française est largement portée par les essais interventionnels, même si les études observationnelles possèdent une volatilité plus importante dans leurs déclarations.
- La France est le seul pays à déclarer ses essais interventionnels à temps sur la source Clinicaltrials.gov et c’est le seul pays en Europe dans ce cas !
- Néanmoins on note une baisse européenne des essais cliniques comme en France sur l’année 2022. Certes le covid a alimenté fortement la recherche ces deux ou trois dernières années mais ce n’est plus le cas.
Ce n’est pas non plus la seule et unique raison de cette baisse qui revient à des niveaux des années pré-covid, voire un peu en dessous. - Beaucoup de changements intervenus en 2022 : règlement européen des DMs repoussé, crise géopolitique et financière mondiale… arrivée des bases de données et registres européens de déclaration des essais…

Bilan des décisions d'accès précoce des médicaments et des PUT-RD un an après la réforme
A travers l’analyse des décisions rendues entre le 01/07/2021 et le 30/06/2022 et mises en ligne sur le site de la HAS, le groupe de travail Accès Précoce de l’AFCROs partage son bilan et sa vision sur la réforme.
Un an après l’entrée en vigueur de la réforme en juillet 2021, alors que plus de 100 demandes ont été déposées par les laboratoires pharmaceutiques, la HAS a rendu 64 décisions concernant les demandes d’autorisation d’AP. Environ deux tiers ont concerné des indications disposant d’une AMM : 41 AAP post-AMM et 23 AAP pré-AMM.

L’utilisation de l'Intelligence Artificielle (IA) dans l’analyse des données de santé en vie réelle
Le monde de la recherche en santé dispose aujourd’hui de très nombreuses sources de données – au niveau national avec le SNDS, ou plus localement via des registres, des établissements de santé ou des entrepôts de données -, et doit faire face à la nécessité de développer des outils analytiques toujours plus adaptés et plus performants pour exploiter au mieux ces données. Créer ces outils analytiques est désormais un enjeu majeur, notamment pour la détection de signaux épidémiques, pour la pharmacovigilance, l’accès au marché des médicaments ou des dispositifs médicaux, ou encore le développement d’outils d’aide à la décision destinés à la pratique médicale. Cette démarche est au croisement de l’épidémiologie telle qu’elle existe depuis des décennies et des méthodes innovantes dites d’Intelligence Artificielle.

Livre blanc | Essais cliniques décentralisés : des paroles aux actes
Fruit de retours d’expérience, d’entretiens avec différentes parties prenantes et de points de vue des différents acteurs de la prise en charge, ce livre blanc a pour objectif de déterminer les conditions optimales de réalisation d’un projet d’étude clinique décentralisée hybride à domicile.
25 octobre 2022

Utiliser les données de vie réelle pour améliorer la pertinence de l’évaluation des produits de santé : les messages clés du guide HAS 2021
Les spécialistes des données de santé en vie réelle du groupe de travail RWD de l’AFCROs nous proposent une synthèse, au travers de quatre communications, des principaux intérêts des données de santé en vie réelle pour l’évaluation des produits de santé, exposés dans ce guide 2021 de la HAS :
2. Analyser les consommations de soins et les coûts associés en vie réelle

Utiliser les données de vie réelle pour améliorer la pertinence de l’évaluation des produits de santé : les messages clés du guide HAS 2021
Les spécialistes des données de santé en vie réelle du groupe de travail RWD de l’AFCROs nous proposent une synthèse, au travers de quatre communications, des principaux intérêts des données de santé en vie réelle pour l’évaluation des produits de santé, exposés dans ce guide 2021 de la HAS :
1. Evaluer la transposabilité des résultats des essais cliniques à la vie réelle

28 JUILLET 2022
Les impacts du RDM sur la recherche clinique : deux exemples concrets
Le groupe DM de l’AFCROs effectue ici une synthèse de la 10ème Journée de la Recherche clinique qui s’est tenue en mars dernier. L’événement incluait notamment un atelier lors duquel les participants ont pu réfléchir à la mise en place d’une stratégie clinique dans deux cas concrets de DM de classe III.

13 JUILLET 2022
Version anglaise du guide AFCROs pour une utilisation pertinente des données du Système national des données de santé (SNDS)
Le groupe de travail RWD de l’AFCROs regroupant des bureaux d’étude experts, présente le premier guide pratique intégrant l’ensemble du circuit de remontée des données dans le SNDS ainsi que quelques recommandations sur la façon la plus pertinente de les utiliser.
Le groupe de travail vous propose une version plus synthétique du précédent document, le tout en anglais pour une meilleure diffusion auprès des groupes internationaux.

21 OCTOBRE 2021
Recherche clinique, quelle place pour le patient ?
Depuis les années 2000, les patients jouent un rôle de plus en plus important dans la prise en charge de leur santé, ils ne « consultent » plus, mais désormais « interagissent » avec les professionnels de santé. Une prise de conscience de la société et du secteur de la santé qui a été révélée avec l’arrivée d’internet dans un premier temps et, plus récemment par les influenceurs patients et les réseaux sociaux, véritables laboratoires d’échanges de leur expérience dans la vraie vie, vis-à-vis de leur maladie, des thérapeutiques qu’ils suivent, de leurs parcours de soins parfois du combattant (de la recherche d’un diagnostic à la prise en charge médicale et psychologique pour eux et leurs proches).

14 septembre 2021
Guide AFCROs pour une utilisation pertinente des données du Système national des données de santé (SNDS)
Le groupe de travail RWD de l’AFCROs regroupant des bureaux d’étude experts, présente le premier guide pratique intégrant l’ensemble du circuit de remontée des données dans le SNDS ainsi que quelques recommandations sur la façon la plus pertinente de les utiliser.

