À condition de se conformer à un cadre règlementaire bien défini, la mise en oeuvre de l’intelligence artificielle dans la recherche clinique va révolutionner les pratiques et la qualité des résultats obtenus. Les experts du groupe de travail Dispositif Médical de l’AFCROs font le point sur les atouts mais aussi les limites actuelles de cette technologie.
Baromètre AFCROs 2025 – Les chiffres clés de la recherche clinique en France
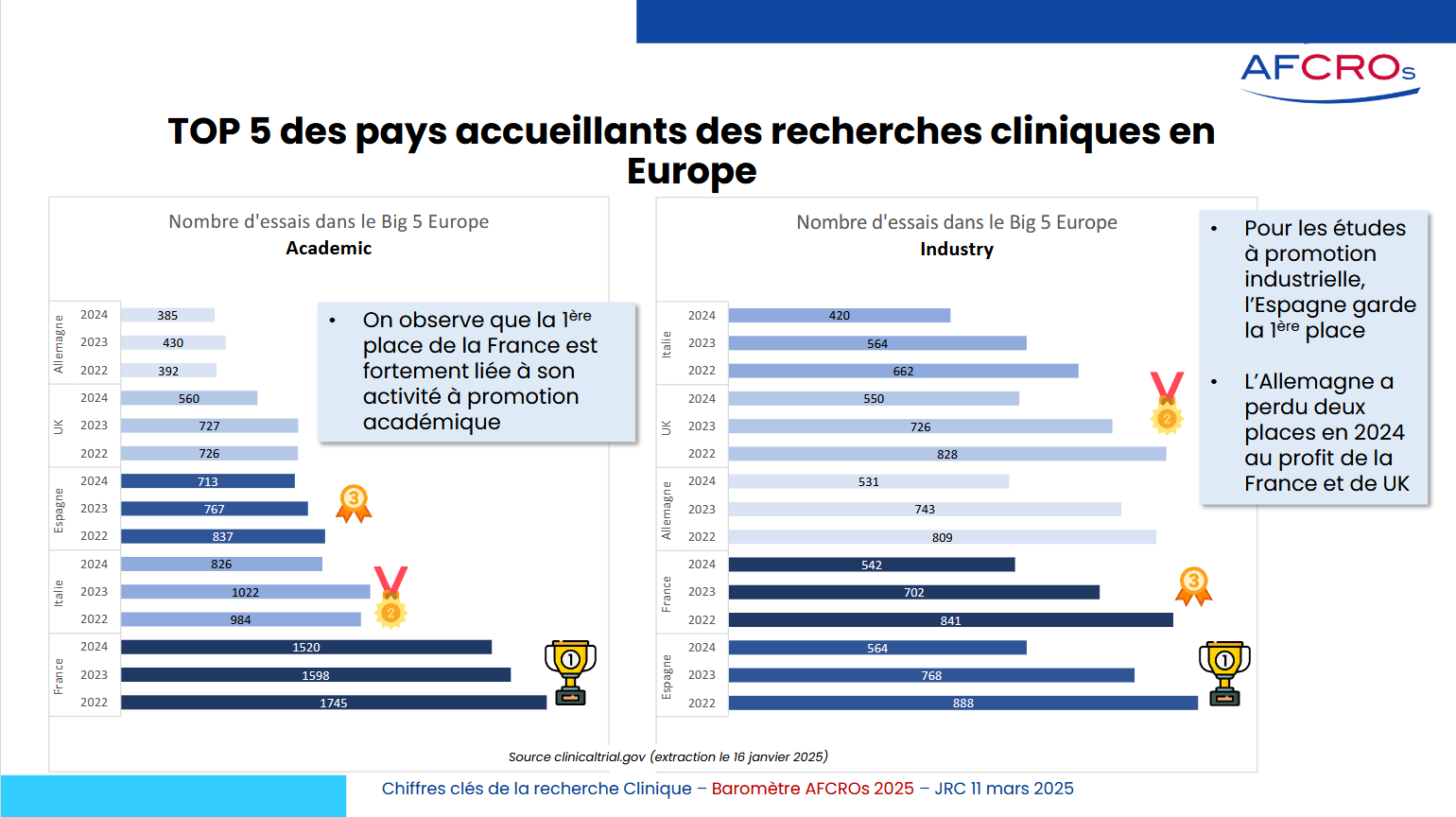
Chiffres clés de la recherche clinique en France
On constate en 2023 une baisse du nombre global de recherche en France, avec une baisse plus importante pour les recherches interventionnelles sur le médicament …
Continue readingA lire : Utiliser des données externes pour l’évaluation clinique d’un DM
Dans le numéro de septembre/octobre de DeviceMed, Nicolas PAGES présente le concept du 𝙗𝙧𝙖𝙨 𝙙𝙚 𝙘𝙤𝙣𝙩𝙧𝙤̂𝙡𝙚 𝙨𝙮𝙣𝙩𝙝𝙚́𝙩𝙞𝙦𝙪𝙚. Grâce à cette approche, des données externes à l’évaluation clinique d’un DM sont utilisées comme base de comparaison pour évaluer les résultats d’un groupe expérimental.
Continue readingPatients et Recherche Clinique, le modèle inspirant de la co-construction
Les études co-construites avec les #patients permettent d’améliorer les capacités d’inclusion, la fluidité de son déroulement mais aussi la qualité des résultats, de spécifier les attendus « qui comptent » pour les patients, de partager la pertinence des objectifs et de les adapter, mais aussi d’ouvrir de nouveaux points de vue de recherche sur des critères jusque-là trop souvent ignorés.
Continue readingEvaluations quantitatives des Expérimentations art.51 : catalyseurs de la culture d’évaluation basée sur les données de santé en France
L’évaluation quantitative des expérimentations article 51 constitue un pilier essentiel pour la transformation du système de santé en France et la promotion d’une culture d’évaluation basée sur les données de santé. Malgré les défis liés à l’accessibilité et à la qualité des données, ainsi qu’à la durée des expérimentations, ce déploiement massif d’évaluations en vie réelle ouvre de nouvelles perspectives pour l’écosystème.
Continue readingNouvel article dans DeviceMed de juillet-août 2023
Dans le numéro de juillet/août 2023 de DeviceMed, Cécile Bultez & Laure Morsiani, membres du groupe de travail Dispositif Médical, expliquent quelques principes de base du Suivi Clinique Après Commercialisation (SCAC) ou Post Market Clinical Follow-up (PMCF).
Elles font un focus sur le domaine de la cardiologie interventionnelle qui a défini des critères uniformes d’évaluation de la performance et de la sécurité de ses Dispositifs Médicaux, avec l’exemple du stent.
Nouvel article dans DeviceMed de mai-juin 2023
Investigations cliniques à des fins de R&D : deux industriels sont venus partager leur expérience lors de la Journée de la Recherche Clinique 2023
Continue readingActualités de mai
Au sommaire :
– Réutilisation des données de santé en vie réelle dans les études cliniques décentralisées
– Promouvoir les métiers de la Recherche Clinique
– Colloque de Données de Santé en vie réelle – mardi 20 juin 2023
– EUCROF News
Réutilisation des données de santé en vie réelle dans les études cliniques décentralisées
Dans cet article, Alexandre Malouvier et Lise Radoszycki, membres du groupe de travail RWD de l’AFCROs, vous proposent d’examiner les concepts clés qui permettent de réutiliser les données de vie réelle et les enjeux de cette réutilisation pour la recherche clinique.
Continue reading